При входе на сайт вы даете согласие на обработку персональных данных в соответствии с пользовательским соглашением
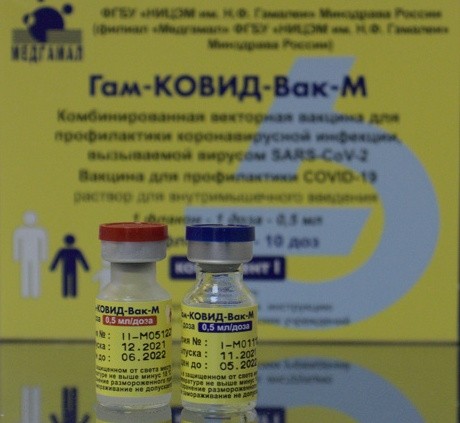
Внешний вид упаковки может отличаться от фотографии
ИНСТРУКЦИЯ ПО МЕДИЦИНСКОМУ ПРИМЕНЕНИЮ ЛЕКАРСТВЕННОГО ПРЕПАРАТА Гам-КОВИД-Вак-М
Комбинированная векторная вакцина для профилактики коронавирусной инфекции,
вызываемой вирусом SARS-COV-2
Регистрационный номер
ЛП-007632
Торговое наименование
Гам-КОВИД-Вак-М Комбинированная векторная вакцина для
профилактики коронавирусной инфекции, вызываемой вирусом SARS-COV-2
Международное непатентованное или группировочное наименование
Вакцина для профилактики СOVID-19
Лекарственная форма
раствор для внутримышечного введения
Состав
на 1 дозу
Компонент I содержит:
Действующее вещество: рекомбинантные аденовирусные частицы 26 серотипа, содержащие ген белка S вируса SARS-COV-2, в количестве (2,0±1,5) x 1010 частиц.
Вспомогательные вещества: трис (гидроксиметил)аминометан - 1,21 мг, натрия хлорид 2,19 мг, сахароза - 25,0 мг, полисорбат 80 – 250 мкг, магния хлорида гексагидрат – 102,0 мкг, ЭДТА динатриевая соль дигидрат – 19,0 мкг, этанол (спирт этиловый) 95% — 2,5 мкл, вода для инъекций - до 0,5 мл.
Компонент II содержит:
Действующее вещество: рекомбинантные аденовирусные частицы 5 серотипа, содержащие ген белка S вируса SARS-COV-2, в количестве (2,0±1,5) х 1010 частиц.
Вспомогательные вещества: трис (гидроксиметил)аминометан — 1,21 мг, натрия хлорид 2,19 мг, сахароза - 25,0 мг, полисорбат 80 - 250 мкг, магния хлорида гексагидрат – 102,0 мкг, ЭДТА динатриевая соль дигидрат – 19,0 мкг, этанол (спирт этиловый) 95% - 2,5 мкл, вода для инъекций - до 0,5 мл.
Описание
Замороженный лекарственный препарат
Компонент 1. Раствор замороженный — плотная затвердевшая беловатого цвета масса. После размораживания: однородный бесцветный или с желтоватым оттенком слегка опалесцирующий раствор.
Компонент II. Раствор замороженный - плотная затвердевшая беловатого цвета масса. После размораживания: однородный бесцветный или с желтоватым оттенком слегка опалесцирующий раствор.
Жидкий лекарственный препарат
Компонент І. Однородный бесцветный или с желтоватым оттенком слегка опалесцирующийраствор.
Компонент II. Однородный бесцветный или с желтоватым оттенком слегка опалесцирующий раствор.
Характеристика
Лекарственный препарат получен биотехнологическим путем, при котором не используется патогенный для человека вирус SARS-COV-2. Лекарственный препарат состоит из двух компонентов: компонент I и компонент II.
В состав компонента І входит рекомбинантный аденовирусный вектор на основе аденовируса человека 26 серотипа, несущий ген белка S вируса SARS-COV-2, в состав компонента II входит вектор на основе аденовируса человека 5 серотипа, несущий ген белка S вируса SARS-COV-2.
Антигенный состав вакцины изменяется в соответствии с эпидемической ситуацией и
рекомендациями ВОЗ и /или рабочей группы экспертов по вопросам иммунопрофилактики инфекционных болезней по вопросу смены штаммового состава вакцин против новой коронавирусной инфекции.
Фармакотерапевтическая группа
МИБП-вакцина, вирусная вакцина, вакцина против COVID-19
Код АТX
J07BN02
Фармакологические свойства
Лекарственный препарат индуцирует формирование гуморального и клеточного иммунитета в отношении коронавирусной инфекции, вызываемой вирусом SARSCoV-2.
Иммуногенность
Иммунологические свойства и безопасность лекарственного препарата изучали в клиническом исследовании у добровольцев обоего пола в возрасте от 12 до 17 лет включительно.
Двукратная иммунизация подростков лекарственным препаратом «Гам-КОВИДВак-М» приводит к формированию напряженного поствакцинального гуморального иммунитета сероконверсия на 28, 42 и 180 дни исследования составила более 98 %.
Проведен анализ защитной эффективности лекарственного препарата Гам-КОВИДВак с обновленным антигенным составом (XBB) в отношении актуальных
циркулирующих вариантов вируса SARSCOV-2 (XBB.1.9, XBB.1.16, EG.5.1) на
модели инфекции у сирийских хомяков.
Показано, что лекарственный препарат Гам-КОВИД-Вак с обновленным составом
защищает животных от инфекции, вызванной циркулирующими вариантами
вируса SARS-COV-2: на 4 сутки после заражения снижение вирусной нагрузки в
легких вакцинированных животных в сравнении с контрольными животными
составило более 3 Ig (более 1000 раз).
Анализ иммуногенности показал, что лекарственный препарат «Гам-КОВИДВак-М» с обновленным антигенным составом (XBB) иммуногена, позволяет сформировать специфический иммунитет к вирусу SARS-COV-2 сублиний варианта Омикрон - ХВВ.1.9.1, XBB.1.16, EG.5.1, BA.2.86 и JN.1.
Защитный титр антител неизвестен.
Продолжительность защиты неизвестна.
Показания к применению
Профилактика COVID-19 у подростков в возрасте от 12 до 17 лет (включительно).
Противопоказания
Гиперчувствительность к какому-либо компоненту лекарственного препарата или
лекарственному препарату, содержащему аналогичные компоненты;
тяжелые аллергические реакции в анамнезе;
острые инфекционные и неинфекционные заболевания, обострение хронических
заболеваний - вакцинацию проводят через 2-4 недели после выздоровления или
наступления ремиссии. При нетяжелых ОРВИ, острых инфекционных заболеваниях
ЖКТ - вакцинацию проводят после нормализации температуры;
возраст до 12 лет (в связи с отсутствием данных об эффективности и безопасности).
Противопоказания для введения компонента II:
тяжелые поствакцинальные осложнения (анафилактический шок, тяжелые
генерализованные аллергические реакции, судорожный синдром, температура тела
выше 40 °С и т.п.) на введение компонента І лекарственного препарата.
C осторожностью
Применять лекарственный препарат с осторожностью при хронических заболеваниях печени и почек, эндокринных заболеваниях (выраженных нарушениях функции щитовидной железы и сахарном диабете в стадии декомпенсации), тяжелых заболеваниях системы кроветворения, эпилепсии и других заболеваниях ЦНС, остром коронарном синдроме и остром нарушении мозгового кровообращения, миокардитах, эндокардитах, перикардитах.
Вследствие недостатка информации вакцинация может представлять риск для следующих групп пациентов:
- с аутоиммунными заболеваниями (стимуляция иммунной системы может привести к
обострению заболевания, особенно следует с осторожностью относиться к пациентам с аутоиммунной патологией, имеющей тенденцию к развитию тяжелых и
жизнеугрожающих состояний);
- со злокачественными новообразованиями.
Принятие решения о вакцинации должно основываться на оценке соотношения пользы и риска в каждой конкретной ситуации.
Применение при беременности и в период грудного вскармливания
Отсутствует опыт клинического применения Гам-КОВИД-Вак-М при беременности.Согласно результатам изучения репродуктивной токсичности на животных не установлено отрицательного влияния на течение беременности, эмбриофетальное развитие и пренатальное развитие потомства. В связи с этим применять лекарственный препарат Гам-КОВИД-Вак-М при беременности следует только в тех случаях, когда ожидаемая польза для матери превышает потенциальный риск для плода с 22-х недель беременности.
Клинические данные по применению лекарственного препарата Гам-КОВИД-Вак-М у женщин, кормящих грудью, и младенцев отсутствуют. В настоящий момент нет данных выделяется ли лекарственный препарат с молоком. Перед принятием решения о вакцинации кормящей женщины необходимо оценить риски и пользу данной вакцинации.
Способ применения и дозы
Лекарственный препарат предназначен только для внутримышечного введения.
Строго запрещено внутривенное введение лекарственного препарата.
Лекарственный препарат вводят в дельтовидную мышцу (верхнюю треть наружной поверхности плеча). При невозможности введения в дельтовидную мышцу — вводят в латеральную широкую мышцу бедра.
Вакцинацию проводят в два этапа: вначале компонентом І в дозе 0,5 мл, затем, через 3 недели компонентом II в дозе 0,5 мл.
После введения лекарственного препарата пациент должен находиться под наблюдением медицинских работников в течение 30 минут.
Замороженный лекарственный препарат
Применение лекарственного препарата производства ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России (филиал «Медгамал» ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России) (флаконы)
Перед иммунизацией флакон с компонентом 1 или II достают из морозильной камеры и выдерживают при комнатной температуре до полного размораживания. Остаток включений льда не допускается! Протирают флакон снаружи салфеткой спиртовой для удаления влаги.
Осторожно перемешивают содержимое покачиванием. Не допускается встряхивание
флакона!
Снимают защитную пластиковую накладку с флакона и обрабатывают резиновую пробку салфеткой спиртовой.
Используя одноразовый шприц с иглой, отбирают дозу 0,5 мл для введения пациенту.
Не допускается хранение размороженного лекарственного препарата!
Повторное замораживание не допускается!
Применение лекарственного препарата производства АО «ГЕНЕРИУМ» (флаконы),ОАО «Фармстандарт-УфаВИТА» (ампулы)
Внимание! Повторное замораживание флакона или ампулы с раствором не допускается! Суммарное время хранения размороженного раствора при комнатной температуре не должно превышать 2 часов. Неиспользованная часть лекарственного препарата подлежит уничтожению.
Перед вакцинированием флакон или ампулу с компонентом I или II достают из морозильной камеры и выдерживают при комнатной температуре до полного размораживания. Остаток включений льда не допускается! Протирают флакон или ампулу снаружи салфеткой спиртовой для удаления влаги. Осторожно перемешивают содержимое покачиванием.
Не допускается встряхивание флакона или ампулы!
Снимают защитную пластиковую накладку с флакона и обрабатывают резиновую пробку салфеткой спиртовой.
Ампулу вскрывают по кольцу и/или точке излома.
Используя одноразовый шприц с иглой, отбирают дозу 0,5 мл для введения пациенту.
Для каждой инъекции необходимо использовать отдельный одноразовый стерильный шприц с иглой.
Внимание! Доза, вводимая пациенту, не должна превышать 0,5 мл!
Многодозовые флаконы
Если последующие инъекции по какой-либо причине откладываются, допускается хранение вскрытого или невскрытого флакона при комнатной температуре не более 2 часов.
Многодозовые ампулы
Содержимое ампулы рекомендуется использовать незамедлительно. Если последующие инъекции по какой-либо причине откладываются, допускается хранение лекарственного препарата при комнатной температуре: вскрытой ампулы, закрытой стерильной салфеткой,не более 1 часа; невскрытой ампулы — не более 2 часов.
ВНИМАНИЕ! Одна ампула содержит две дозы лекарственного препарата. Объем одной дозы составляет 0,5 мл. Одному пациенту вводить 1 дозу (0,5 мл).
Однодозовые ампулы
Содержимое ампулы рекомендуется использовать незамедлительно после полного
размораживания раствора. Если последующие инъекции по какой-либо причине
откладываются, допускается хранение невскрытой ампулы при комнатной температуре не более 2 часов.
Жидкий лекарственный препарат
Применение лекарственного препарата производства АО «ГЕНЕРИУМ» (флаконы), ОАО «Фармстандарт-УфаВИТА» (ампулы)
Внимание! Замораживание флакона или ампулы с раствором не допускается!
Неиспользованный лекарственный препарат подлежит уничтожению.
Перед вакцинированием флакон или ампулу с компонентом I или II достают из холодильника и выдерживают при комнатной температуре, допускается слегка нагреть препарат, например, подержав его в руках. Не следует нагревать лекарственный препарат выше 37 °С.
Снимают защитную пластиковую накладку с флакона и обрабатывают резиновую пробку салфеткой спиртовой.
Ампулу вскрывают по кольцуи/или точке излома.
Используя одноразовый шприц с иглой, отбирают дозу 0,5 мл для введения пациенту. Дл якаждой инъекции необходимо использовать отдельный одноразовый стерильный шприц с иглой.
Внимание! Доза, вводимая пациенту, не должна превышать 0,5 мл!
Многодозовые флаконы
Если последующие инъекции по какой-либо причине откладываются, допускается хранение вскрытого или невскрытого флакона при комнатной температуре не более 2 часов.
Многодозовые ампулы
Содержимое ампулы рекомендуется использовать незамедлительно. Если последующие инъекции по какой-либо причине откладываются, допускается хранение вакцины при комнатной температуре: вскрытой ампулы, закрытой стерильной салфеткой, не более 1 часа; невскрытой ампулы - не более 2 часов.
ВНИМАНИЕ! Одна ампула содержит две дозы лекарственного препарата. Объем одной дозы составляет 0,5 мл. Одному пациенту вводить 1 дозу (0,5 мл).
Однодозовые ампулы
Содержимое одной ампулы рекомендуется использовать незамедлительно. Если
последующие инъекции по какой-либо причине откладываются, допускается хранение
невскрытой ампулы при комнатной температуре не более 2 часов.
Побочное действие
Нежелательные реакции (НР), характерные для применения лекарственного препарата и выявленные в рамках клинических исследований, были преимущественно легкой или средней степени выраженности, развивались в первые-вторые сутки после вакцинации и разрешались в течение 3-х последующих дней. Рекомендуется назначение нестероидных противовоспалительных средств (НПВС) при повышении температуры после вакцинации и антигистаминных средств при выраженной местной реакции.
Частота встречаемости определяется следующим образом: очень часто (1/10), часто (1/100и <1/10), нечасто (1/1000 и <1/100), редко (1/10000 и <1/1000), очень редко (<1/10000, включая отдельные случаи). Категории частоты были сформированы на основании клинических исследований лекарственного препарата.
B рамках проведенных клинических исследований и пострегистрационного фармаконадзора были зарегистрированы следующие нежелательные реакции:
«Общие нарушения и реакции в месте введения»: пирексия, боль в месте вакцинации, отек в месте вакцинации, эритема в месте вакцинации, зуд в месте вакцинации, гриппоподобное заболевание очень часто; озноб, астения, недомогание, усталость, боль в грудной клетке, ощущение жара - часто.
«Нарушения со стороны дыхательной системы, органов грудной клетки и средостения»: заложенность носа - боль в ротоглотке (орофарингеальная), ринорея, кашель, першение в горле - нечасто.
«Нарушения со стороны иммунной системы»: гиперчувствительность - очень редко.
«Нарушения со стороны нервной системы»: головная боль; головокружения - часто.
«Нарушения со стороны мышечной, скелетной и соединительной ткани»: миалгия — часто; артралгия, боль в конечности - нечасто.
«Желудочно-кишечные нарушения»: тошнота - часто; рвота, диспепсия, боль в животе, диарея - нечасто.
«Нарушения со стороны кожи и подкожной клетчатки»: гипергидроз, сыпь — нечасто.
«Нарушения со стороны крови и лимфатической системы»: лимфаденопатия – нечасто.
«Нарушения со стороны органа зрения»: боль в глазу - редко.
«Нарушения метаболизма и питания»: снижение аппетита – часто.
«Лабораторные и инструментальные данные»: транзиторные разнонаправленные отклонения показателей.
Все НЯ завершились выздоровлением без последствий. Лабораторные отклонения не имели клинического значения (не нуждались в проведении дополнительных диагностических процедур и назначении терапии).
Передозировка
О случаях передозировки не сообщалось.
Учитывая, что отпуск лекарственного препарата допускается только для лечебно-профилактических учреждений, а сама вакцинация проводится только квалифицированным медицинским персоналом, риск передозировки крайне низок.
Однако можно предположить, что при случайной передозировке возможно развитие
указанных выше токсических и токсико-аллергических реакций в более тяжелой степени.
Специфических антидотов к лекарственному препарату не существует.
Терапевтические мероприятия в данном случае будут включать симптоматическую терапию в соответствии с показаниями (жаропонижающие/НПВС и десенсибилизирующие средства, кортикостероиды - парентерально при выраженном токсико-аллергическом синдроме).
Режим назначения лекарственных препаратов должен быть выбран согласно рекомендациям по применению и дозировкам данного лекарственного средства.
Взаимодействие с другими лекарственными средствами
Не изучалось. Ввиду отсутствия данных исследований совместимости, лекарственныйпрепарат Гам-КОВИД-Вак-М (Комбинированная векторная вакцина для профилактикикоронавирусной инфекции, вызываемой вирусом SARS-COV-2) нельзя смешивать с другими иммунобиологическими лекарственными препаратами или иными лекарственными средствами в одном шприце.
Особые указания
У пациентов, получающих иммуносупрессивную терапию, и пациентов с иммунодефицитом может не развиться достаточный иммунный ответ. Применение иммуносупрессивнойтерапии (лекарственные препараты, подавляющие работу иммунной системы, в т.ч. химиотерапия, некоторые виды иммунобиологической терапии, длительный прием высоких доз кортикостероидов) может снижать иммунный ответ на вакцинацию. Лечащему врачу следует определить целесообразность вакцинации и/или подобрать оптимальные сроки для вакцинации в периоды наименьшей интенсивности лечения.
Подобно остальным иммунобиологическим лекарственным препаратам, защитный иммунный ответ может возникать не у всех вакцинируемых лиц.
Влияние на способность управлять транспортными средствами, механизмами
Исследования по изучению влияния лекарственного препарата на способность управлять транспортными средствами и потенциально опасными механизмами не проводились.
Форма выпуска
Раствор для внутримышечного введения, компонент I - 0,5 мл/доза + компонент II
0,5 мл/доза.
Замороженный лекарственный препарат
При производстве на ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России (филиал «Медгамал» ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России):
по 0,5 мл (1 доза) каждого компонента лекарственного препарата во флаконы
нейтрального стекла І гидролитического класса типа 2R, герметично укупоренные
пробками из резины, обжатые алюмопластиковыми колпачками.
По 1 флакону компонента I с инструкцией по медицинскому применению помещают
в пачку картонную или в пачку из картона коробочного; по 1 флакону компонента II с
инструкцией по медицинскому применению помещают в пачку картонную
или в пачку из картона коробочного.
По 5 флаконов I компонента или компонента II помещают в контурную ячейковую упаковку из пленки поливинилхлоридной. По 1 или 2 контурные ячейковые упаковки
с компонентом I или компонентом II вместе с инструкцией по медицинскому
применению помещают в пачку картонную или в пачку из картона коробочного.
При производстве на АО «ГЕНЕРИУМ»:
по 3,0 мл (5 доз) каждого компонента во флаконы нейтрального стекла І гидролитического класса типа 2R, герметично укупоренные пробками резиновыми, с обкаткой колпачками алюминиево-пластиковыми с контролем первого вскрытия.
По 1 флакону с компонентом I или с компонентом II вместе с инструкцией по
медицинскому применению помещают в пачку из картона с поролоновым
держателем из пенополиуретана.
При производстве на ОАО «Фармстандарт-УфаВИТА»:
по 0,5 мл (1 доза) или по 1,0 мл (2 дозы) каждого компонента лекарственного
препарата в ампулы из бесцветного стекла І гидролитического класса, вместимостью
2 мл с кольцом и/или точкой излома.
По 5 ампул каждого компонента лекарственного препарата помещают в контурную ячейковую упаковку из пленки поливинилхлоридной.
По 1 или 2 контурные ячейковые упаковки вместе с инструкцией по медицинскому
применению помещают в пачку из картона.
Жидкий лекарственный препарат
При производстве на АО «ГЕНЕРИУМ»:
по 3,0 мл (5 доз) каждого компонента во флаконы нейтрального стекла I гидролитического класса типа 2R, герметично укупоренные пробками резиновыми, с обкаткой колпачками алюминиево-пластиковыми с контролем первого вскрытия.
По 1 флакону с компонентом I или с компонентом II в контурной ячейковой упаковке из пленки поливинилхлоридной или полиэтилентерефталатной вместе с инструкцией по медицинскому применению помещают в пачку из картона или без контурной ячейковой упаковки вместе с инструкцией по медицинскому применению помещают в пачку из картона с поролоновым держателем из пенополиуретана.
При производстве на ОАО «Фармстандарт-УфаВИТА»:
по 0,5 мл (1 доза) или по 1,0 мл (2 дозы) каждого компонента лекарственного препарата в ампулы из бесцветного стекла І гидролитического класса вместимостью 2 мл с кольцом и/или точкой излома.
По 5 ампул каждого компонента лекарственного препарата помещают в контурную ячейковую упаковку из пленки поливинилхлоридной.
По 1 или 2 контурные ячейковые упаковки вместе с инструкцией по медицинскому
применению помещают в пачку из картона.
Условия хранения
Замороженный лекарственный препарат
Хранить в защищенном от света месте, при температуре не выше минус 18 °С. Повторное замораживание не допускается.
Хранить в недоступном для детей месте.
Жидкий лекарственный препарат
Хранить в защищенном от света месте, при температуре от 2 до 8 °С. Не замораживать.
Хранить в недоступном для детей месте.
Условия транспортирования
Замороженный лекарственный препарат
При температуре не выше минус 18 °С.
Жидкий лекарственный препарат
При температуре от 2 до 8 °С. Не замораживать.
Срок годности
Замороженный лекарственный препарат
Производственные площадки ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России
(филиал «Медгамал» ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России), Россия,
АО «ГЕНЕРИУМ», Россия, ОАО «Фармстандарт-УфаВИТА», Россия:
Компонент 1 — 9 месяцев. Компонент II — 9 месяцев.
Не применять по истечении срока годности.
Жидкий лекарственныйпрепарат
Производственные площадки АО «ГЕНЕРИУМ», Россия, ОАО «Фармстандарт-УфаВИТА»,Россия:
Компонент I - 6 месяцев. Компонент II - 6 месяцев.
Не применять по истечении срока годности.
Условия отпуска
для лечебно-профилактических учреждений.
Производитель
Наименования и адреса производственных площадок производителей лекарственного препарата:
1) ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России (филиал «Медгамал»
ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России), Россия, 123098, г. Москва,
ул. Гамалеи, д. 18 (все стадии производства).
2) АО «ГЕНЕРИУМ», Россия, 601125, Владимирская обл., Петушинский район,пос. Вольгинский, ул. Заводская, стр. 263 (производство готовой лекарственной формы,первичная и вторичная (потребительская) упаковка).
3) ОАО «Фармстандарт-УфаВИТА», Россия, Республика Башкортостан, г. Уфа,ул. Худайбердина, д. 28 (производство готовой лекарственной формы, первичная и вторичная (потребительская) упаковка).
Выпускающий контроль качества
Филиал «Медгамал» ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России, Россия, 123098, Москва, ул. Гамалеи, д. 18
Владелец регистрационного удостоверения/организация, принимающая претензии
потребителя
ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России (филиал «Медгамал»
ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России),
Россия, 123098, г. Москва, ул. Гамалеи, д. 18.
Тел: 8 499-193-30-01.
E-mail: info@gamaleya.org
Вы смотрели